آموزش شیمی 4
نکات کنکوری و مفهوم اسید و باز در نظریه آرنیوس
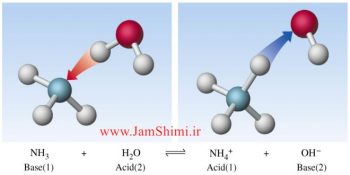
اسید در نظریه آرنیوس ماده ای است که اولا در آب حل شده، دوما یون هیدروژن یا پروتون آزاد یا تولید کند. و باز در نظریه آرنیوس ماده ای است که اولا در آب حل شده، دوما یون هیدروکسید آزاد یا تولید کند.در ادامه نکات مهم و کنکوری اسید آرنیوس و باز آرنیوس برای یادگیری و آمادگی بیشتر شما آمده است
نکات مهم و طبقه بندی شده اسید آرنیوس
- اسیدهای آرنیوس که در ساختمان خود H داشته باشند، در آب H(مثبت) آزاد می کنند مثل HCl
- اسیدهای آرنیوس که در ساختمان خود H ندارند می گوییم در آب H (مثبت) تولید می کنند مثل N2O5
- هیدروژن هالیدها اسید آرنیوس هستند زیرا با حل شدن در آب یون هیدروژن آزاد می کنند که به محلول آنها هیدروهالیک اسید می گویند مثل: HF، HCl، HBr..
- نافلزهای فعال اسید آرنیوس هستند زیرا آنها با آب واکنش داده و یون هیدروژن تولید می کنند مثل :
Cl2+ H2O —> HClO + H + Cl - اکسیدهای نافلزی محلول در آب اسید آرنیوس هستند (اکسیدهای اسیدی) مثل CO2، SO3، N2O5
- مولکولهای CO، NO و N2O اگرچه اکسیدهای نافلزی هستند ولی به دلیل قطبیت بسیار کم، انحلال پذیری بسیار کم در آب دارند و بصورت مولکولی حل شده و نمی توانند یون هیدروژن در آب تولید کنند به همین دلیل اسید آرنیوس به شمار نمی روند.
- الکل ها با اینکه در ساختار خود OH- دارند مثل متانول و اتانول، اما به هنگام حل شدن در آب یون H تولید نمی کنند و اسید آرنیوس نیستند.
- فنول بر خلاف الکل ها به هنگام انحلال در آب به مقدار جزئی تفکیک شده و یون پروتون تولید می کند و اسید آرنیوس به شمار می آید.
نکات مهم و طبقه بندی شده باز آرنیوس
- باز در نظریه آرنیوس ماده ای است که اولا در آب حل شده، دوما یون هیدروکسید آزاد یا تولید کند.
- هیدروکسیدهای فلزات گروه اول و دوم به جز بریلیم و منیزیم در آب محلول بوده و باز آرنیوس محسوب می شوند مانند NaOH، KOH
- فلزات گروه اول و دوم (به جز بریلیم و منیزیم) با آب واکنش داده و یون هیدروکسید تولید می کنند، پس باز آرنیوس هستند.
- اکسیدهای فلزات اول و دوم (به جز بریلیم و منیزیم) در آب محلول بوده و یون هیدروکسید تولید می کنند پس باز آرنیوس هستند مثل: K2O، CaO
- آمونیاک و آمین ها باز آرنیوس هستند.
- الکل ها با اینکه در ساختار خود OH- دارند اما در آب کاملا مولکولی حل شده و یون هیدروکسید تولید نمی کنند، پس باز آرنیوس نیستند.
قابلیت های نظریه آرنیوس
- این نظریه یونش و تفکیک اسیدها و بازها را در محیط آبی توجیه می کند.
- رسانایی جریان الکتریسیته محلول اسید و باز را می توان با این نظریه توجیه کرد.
- واکنش خنثی شدن اسید و باز که منجر به تولید نمک و آب می شود با این نظریه قابل توجیه است.
- قدرت اسیدی و بازی را می توان با این نظریه توجیه کرد. هر ماده ای H بیشتری تولید کند اسید قویتری است.
نارسایی های نظریه آرنیوس
- این نظریه فقط برای ترکیباتی قابل استفاده است که در آب محلول باشد و در حلال های غیر آبی کاربرد ندارد.
- برای موادی که نتوانند در محلول یون هیدروژن یا هیدروکسید تولید کنند قابل استفاده نیست.
- در این نظریه آب هیچ نقش اسیدی یا بازی در انحلال اسیدها و یا بازها ندارد.
- آب پوشی یون هیدروژن با آب و تبدیل آن به یون هیدرونیوم با این نظریه قابل توجیه نیست.
- خاصیت آمفوتری مواد با این نظریه قابل توجیه نیست.
لینک کوتاه مطلب
برای کپی کلیک کنید





