اسیدهای چند پروتونی یا چند ظرفیتی و یونش آن ها

برخی از اسیدها مانند HCl پس از حل شدن در آب تنها یک پروتون به مولکول آب میدهد این اسیدها به نام اسیدهای تک پروتونی میشناسیم اما اسیدهایی هم که مانند اسید فسفریک وجود دارند که موقع انحلال در آب سه پروتون از دست میدهد. در این گونه اسیدها از دست دادن هر پروتون طی یک مرحله تعادلی انجام میشود و هر مرحله ثابت تفکیک (Ka) مخصوص به خود دارد برای اسیدهای پروتونی سهم تولید یون هیدرونیوم +(H3O) از مراحل تفکیک دوم یا سوم به قدری کم است که میتوان از آنها چشم پوشی کرد.
اسیدهای چند پروتون دار :
اسیدهایی که دارای دو یا چند پروتون اسیدی هستند مثل H2S,H2SO4
از بین اسید های چند ظرفیتی فقط سولفوریک اسید H2SO4 اسید قوی است.و بقیه اسید ضعیف هستند.
اسیدهای چندپروتون دار به تعداد H های اسیدی دارای مرحله یونش هستند. در هر مرحله یک H از دست میدهند.
در هر مرحله از یونش این اسید ها Ka کوچکتر و PKa بزرگتر میشود
(Ka(n)>Ka(n+1
(PKa(n)<PKa(n+1
در هر مرحله جدا شدن هیدروژن اسیدی سخت تر میشود. جدا شدن H در مرحلهn+1 سختتر از مرحلهn ام است
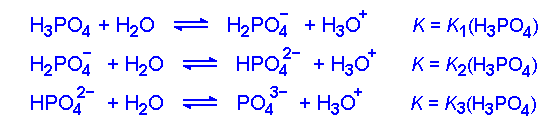
پس در محلول اسید فسفریک سه تعادل همراه با تعادل آب وجود دارند. در این محلول گونههای زیر وجود دارند. H3PO4 ، H2PO4– ، H2PO42- ، PO43- ، H+، OH– ، H2O.
یونش فسفریک اسید،در این گونه اسیدها K1 بیشتر از K2 و K2 هم بیشتر از K3 میباشد. به این مفهوم که آزاد شدن پروتون از یک مولکول بی بار در مقایسه با یک یون با یک بار منفی آسان تر میگیرد در این عمل هم در یک یون با یک بار منفی آسان تر از یک یون با دو بار منفی صورت میگیرد.
اسیدهای چندپروتونی ترکیب هایی هستند که دارای بیش از یک هیدروژن اسیدی هستند و به طور متوالی تفکیک میشوند.
اسیدهای تک پروتونی تنها یک واکنش تکفکیک دارند و فقط یک ثابت تفکیک اسید دارند:
-
-
-
-
- HA(aq) + H۲O(l) ⇌ H۳O+(aq) + A−(aq) Ka
-
-
-
یک اسید دوپروتونی (در این جا آن را با H۲A نشان میدهیم) بسته به مقدار pH میتواند یک یا دو واکنش تکفکیک داشته باشد. هر واکنش یک ثابت تفکیک اسید دارد، Ka۱ و Ka۲:
-
-
-
-
- H۲A(aq) + H۲O(l) ⇌ H۳O+(aq) + HA−(aq) Ka۱
-
-
-
-
-
-
-
- HA−(aq) + H۲O(l) ⇌ H۳O+(aq) + A۲−(aq) Ka۲
-
-
-
ثابت تفکیک اولی همواره بیشتر از دومی است، یعنی Ka۱ > Ka۲. برای مثالسولفوریک اسید (H۲SO۴) میتواند یک پروتون بدهد و به آنیون بیسولفات(HSO۴−) تبدیل شود. هنگامی که Ka۱ بسیاز بزرگ باشد، در این صورت میتواند دومین پروتون خود را بدهد و به آنیون سولفات (SO۴۲−) تبدیل شود. (SO۴۲−) هم مقدار متوسطی دارد. مقدار بزرگ Ka۱ در اولین تفکیک باعث میشود که سولفوریک اسید، اسیدی قوی باشد. همانند این، مقدار کوچک کربنیک اسید (H۲CO۳) میتواند اولین پروتون را بدهد و به آنیون بیکربنات (HCO۳−) تبدیل شود و دومین پروتون را بدهد و به کربنات (CO۳۲−) تبدیل شود. هر دو مقدار Ka کوچک هستند اما داریم Ka۱ > Ka۲.
یک اسید سهپروتونی (H۳A) میتواند یک یا دو یا سه پروتون بدهد و سه مقدار ثابت تفکیک برای آن وجود دارد، به طوری که Ka۱ > Ka۲ > Ka۳>:
-
-
-
-
- H۳A(aq) + H۲O(l) ⇌ H۳O+(aq) + H۲A−(aq) Ka۱
-
-
-
-
-
-
-
- H۲A−(aq) + H۲O(l) ⇌ H۳O+(aq) + HA۲−(aq) Ka۲
-
-
-
-
-
-
-
- HA۲−(aq) + H۲O(l) ⇌ H۳O+(aq) + A۳−(aq) Ka۳
-
-
-
یک مثال غیرآلی از اسید سهپروتونی فسفریک اسید (H۳PO۴) است. تمام پروتونها میتوانند از دست داده شوند و به H۲PO۴−، سپس HPO۴۲−، و در آخر PO۴۳− تبدیل شود. یک مثال آلی از اسید سهپروتونی اسید سیتریک است، که میتوانند تمام پروتونهای خود را بدهد و در انتها به یون فسفات تبدیل شود.
فسفر۳اکسی اسید ضعیف دارد.
۳هیدروژن اسیدی،۳ظرفیتیH3PO4
۲هیدروژن اسیدی،۲ظرفیتی H3PO3
۱هیدروژن اسیدی،۱ظرفیتی H3PO2
در بین گونه های موجود در محلول فسفریک اسید H3PO4 و H3O+ فقط اسید هستند.
در این محلول ، H2PO42- ، PO43 و آب نقش باز دارند.
در این محلول H2PO42 و H2PO4 نقش آمفوتر دارند.
فسفریک اسید H3PO4 پر مصرف ترین مواد شیمیایی،ماده افزودنی در نوشابه گازدار،کود شیمیایی، پاک کننده های صابونی،تصفیه آب،خوراک دام و دارو سازی کاربرد دارد.
فسفریک اسید خوراکی را از P4O10 تهیه میکنند.
P4O10(s)+6H2O(l)===> 4H3PO4