آموزش شیمی دهم
نکات مهم و کنکوری شیمی ایزوتوپ های عناصر و خواص آن ها
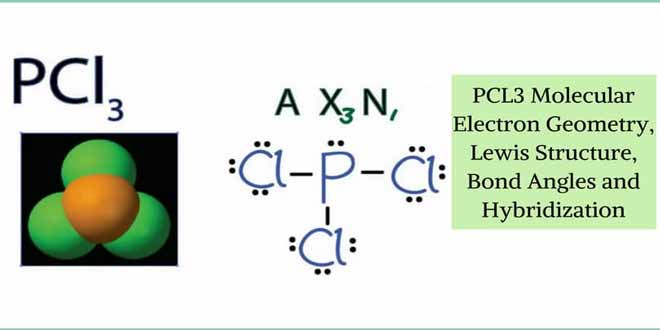
ایزوتوپ چیست؟ اتم های یک عنصر که عدد اتمی یکسان ولی عدد جرمی متفاوتی دارند. تفاوت ایزوتوپ ها به دلیل تفاوت در تعداد نوترون های هسته ی آن ها می باشد. در ادامه از جم شیمی نکات مهم و کنکوری شیمی ایزوتوپ های عناصر و خواص آن ها و همین طور تفاوت ها و شباهت های ایزوتوپ های عناصر و تعداد ایزوتوپ های هر عنصر به صورت دسته بندی و طبقه بندی شده آورده شده است.
نکات مهم و کنکوری شیمی ایزوتوپ های عناصر و خواص آن ها
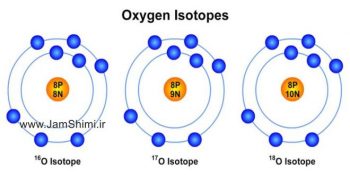
- هیدروژن دارای سه ایزوتوپ به اسم های پروتیوم و دوتریم و تریتیم می باشد.
- ایزوتوپ از دو واژه ی یونانی ایزو (برابر، یکسان) و توپوس (جا) گرفته شده است.
- اتم هایی که ایزوتوپ همدیگر هستند در جدول تناوبی به یک خانه تعلق دارند.
- ایزوتوپ ها عدد اتمی یکسان ولی عدد جرمی متفاوتی دارند.
- تفاوت ایزوتوپ ها به علت تفاوت در تعداد نوترون هاست
- ایزوتوپی که فراوانی بیشتری در طبیعت داشته باشد ایزوتوپ پایدار محسوب می شود. مثلا کلر35 ایزوتوپ پایدار کلر است.
- فراوانی ایزوتوپ های هیدروژن به صورت رو برو است: H > D > T
- ایزوتوپ های یک عنصر خواص شیمیایی یکسانی دارند، چون تعداد الکترون برابری دارند.
- خواص فیزیکی وابسته به جرم ایزوتوپ ها مانند چگالی، نقطه ذوب و جوش متفاوت است.
- پایداری ایزوتوپ ها به تعداد پروتون و نوترون درون هسته بستگی دارد.
- هسته هایی با تعداد پروتون بیشتر از 84 ناپایدار هستند. یا اگر نسبت تعداد نوترون به پروتون 1.5 یا بیشتر از این باشد ناپایدار است.
- عناصر فلوئور، فسفر و آلومینیوم فقط یک ایزوتوپ پایدار دارند.
- قلع، 10 ایزوتوپ پایدار دارد.
امتیاز کاربران
مفید بودن مطلب
لینک کوتاه مطلب
برای کپی کلیک کنید
کپی شد