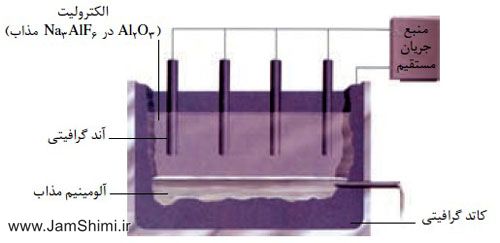
آموزش شیمی 4
اثر دما بر PH آب خالص

از نظر ماهیت اسید و بازی، آب خالص یك ماده خنثی می باشد . به دلیل این كه در آب خالص، در اثر خود یونش آب غلظت یونهای هیدرونیوم +H3O و هیدروكسید –OH ، با هم برابر است . در دمای 25 درجه سلسیوس غلظت هر یك از یونهای مورد نظر با هم برابر و برابر 7-10 مول بر لیتر است .
پس برای آب خالص در 25 درجه سلسیوس، ثابت یونش آب Kw به صورت زیر تعریف می شود :
Kw = [H3O+] [OH-] = 10-14 mol2/L2
فرایند خود یونش آب، واكنشی گرماگیر است . یعنی اگر دما افزایش یابد، میزان خود یونش آب بیشتر شده و غلظت یونهای هیدرونیوم وهیدروكسید بزرگتر از 7-10 خواهد شد .
در این حالت ثابت یونش آب نیز بزرگتر از 14-10 خواهد شد .
موضوع را با ذكر دو مثال بررسی می كنیم .
مثال شماره یك : فرض كنیم در دمایی بالاتر از 25 درجه سلسیوس داده های زیر را داشته باشیم :
H3O+] = 10-5 ] وOH-] = 10-5]
بنابر این ثابت یونش آب به صورت زیر خواهد بود
Kw = [H3O+] [OH-] = 10-10 mol2/L2
در این حالت محدوده PH ، آب خالص دیگر بین صفر تا 14 نخواهد بود و در این دما محدوده آن بین صفر تا 10 است . و PH حالت خنثی 5 = PH ، می باشد .
مثال شماره دو : فرض كنیم در دمایی پایینتر از 25 درجه سلسیوس داده های زیر را داشته باشیم :
H3O+ = 10-8 و OH-] = 10-8
بنابر این ثابت یونش آب به صورت زیر خواهد بود
Kw = [H3O+] [OH-] = 10-16 mol2/L2
در این حالت محدوده PH ، آب خالص دیگر بین صفر تا 14 نخواهد بود و در این دما محدوده آن بین صفر تا 16 است . و PH حالت خنثی 8 = PH ، می باشد .
به این ترتیب به نظر شما آیا این جمله همیشه درست است : آب خاص در هر دمایی خنثی است
لینک کوتاه مطلب
برای کپی کلیک کنید
کپی شد