نکات الكترونگاتيوي عناصر
الکترونگاتیوی

الكترونگاتيوي تمایل نسبی یک اتم به جذب جفت الکترون های پیوندی دریک مولکول پایدار را الکترونگاتیوی گویند. راه های محاسبه الکترونگاتیوی که توسط پاولینگ انجام شد طبق معادله های زیر می باشد.
DAB = 1/2 ( DA-A+DB-B) + 23(XA-XB)2
و A = XA 125( الکترونخواهی – انرژی یونش )
که درآن X الکترونگاتیوی وD انرژی تفکیک پیوند می باشد .
الکترونگاتیوی یک اتم به دوعامل بستگی دارد :
1- بارموثرهسته اتم
2- فاصله الکترون هالایه ظرفیت ازهسته (شعاع)
)


هرچه بارموثرهسته بیشتر واندازه اتم کوچکتر باشد میزان جاذبه هسته برالکترون های لایه ظرفیت ودرنتیجه الکترونگاتیوی بیشتر می شود.
بارموثر هسته باری است که هرالکترون باوجودالکترون های داخلی اتم که نقش حایل دارند٬ ازهسته احساس می کند بار موثرهسته کمتراز بار واقعی ( تعداد پروتون) آن است .
روبرت مولیگن نیز مقیاس دیگری برای محاسبه الکترونگاتیوی در سال 1934 وضع نمود.
2/ ( EI -EA ) = الکترونگاتیوی
الکترونخواهی EA1
عبارت است ازانرژی مبادله شده به هنگام افزایش یک مول الکترون به یک مول اتم به حالت گاز .
دربیشتر موارد با اضافه کردن اولین الکترون به اتم انرژی آزاد می شود .زیرا الکترون توسط هسته اتم جذب می شود بنابراین معمولا مقدار Δ E منفی است .درعناصر گروه IIA که اوربیتال S پراست(پایداری نسبی دارد) ویا گروه VA که ازآرایش الکترونی نسبتا پایدار (به علت تقارن کروی ) برخوردارهستند الکترونخواهی کاهش می یابد .
g) Δ E = EA1 ) – یون <——– g ) + e ) اتم
افزون بربارموثرهسته وشعاع اتم عوامل دیگری نیزبرالکترونخواهی اتم تاثیر می گذارند.وظاهرا نظمی مشابه الکترونگاتیوی در روند تغییر الکترونخواهی به چشم نمی خورد . این بی نظمی حاصل از تغییر درانرژی زیرلایه ای است که الکترون به آن وارد می شود وهمچنین به دافعه بین الکترونی بستگی دارد.
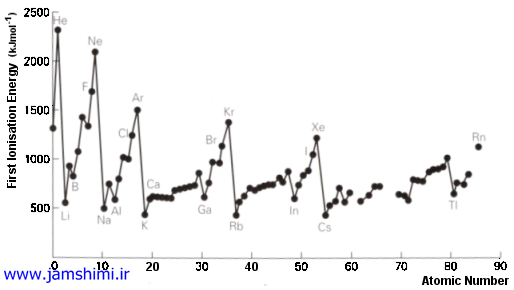
انرژی یونش E1
مقدارانرژی مورد نیاز برای جدا کردن یک مول ازسست ترین الکترون ازاتم به حالت گاز . (نخستین یونش)
(g )+یون + g ) + E1 ——–> e ) اتم



به نمودارها وجدول توجه نمایید .به طور کلی می توان نتیجه گرفت روند تغییر الکترونگاتیوی والکترونخواهی وانرژی یونش درجدول تناوبی به این قرار است که دریک دوره تناوب ازچپ به راست افزایش ودریک گروه از بالا به پایین کاهش می یابد.

.
گازهای نادر گروه (VIII A ) به علت کامل بودن لایه ظرفیت درآنها تمایلی به گرفتن یا دادن الکترون ندارند. انرژی یونش زیاد و الکترونخواهی مثبت درآنها نشانه دشواری تشکیل یون با این اتم ها می باشد.
باید توجه داشت الکترونخواهی وانرژی یونش ازخواص اتم های مجزا می باشد . وازجنس انرژی و با واحدهای انرژی بیان می شوند. اما الکترونگاتیوی چون مقایسه خاصیتی واحد٬ ازهرعنصر را نشان می دهد ( نسبی ) یک عدد بدون واحد است.