نکات مهم و کنکوری سلول الکتروشیمیایی روی-مس شیمی دوازدهم
سلول الکتروشیمیایی روی-مس یکی از موضوعات مهم و کنکوری شیمی دوازدهم فصل دوم می باشد که در ادامه از جم شیمی به بررسی و جمعبندی نکات مهم و کنکوری سلول الکتروشیمیایی Zn-Cu پرداخته شده است. مطالعه این نکات مهم به دانش آموزان و داوطلبان کنکور شیمی دوازدهم توصیه می کنیم.
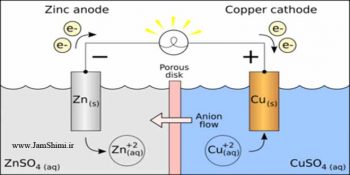
سلول الکتروشیمیایی روی-مس
فرآیند آندی
در آند فلز روی در محلولی از روی نیترات قرار دارد. فلز روی با از دست دادن دو الکترون به یون روی دو بار مثبت تبدیل شده و وارد خانه آندی می شوند.
فرآیند کاتدی
درکاتد فلز مس در محلولی از مس (II) نیترات قرار دارد. یون های مس در محلول با گرفتن دو الکترون به فلز مس احیا شده و روی تیغه مس می نشینند.
جهت حرکت الکترون
جریان الکترون در مدار بیرونی (سیم ) از سمت آند به سمت کاتد است اما تا زمانی که پل نمکی (دیواره متخلخل) نباشد هیچ جریانی عبور نمی کند
نقش پل نمکی
پل نمکی حاوی سدیم نیترات غلیظ است. چون یون های روی دو بار مثبت وارد خانه آندی می شوند این قسمت بار مثبت پیدا می کند برای خنثی ماندن این خانه یون های نیترات با بار منفی از پل نمکی وارد خانه آندی می شوند.
در خانه کاتدی چون یون های مس دوبار مثبت از محلول خارج می شوند این خانه بار منفی پیدا می کند. برای خنثی ماندن آن یون های سدیم مثبت از پل نمکی وارد خانه کاتدی می شوند.
- الکترون از آند به سمت کاتد حرکت می کند.
- کاتیون از پل نمکی به سمت کاتد حرکت می کند.
- آنیون از پل نمکی به سمت آند حرکت می کند.
تغییر جرم الکترودها با ادامه اکسایش-کاهش
فلز روی در آند سبک تر شده ولی فلز مس در کاتد سنگین می شود. غلظت یون روی در خانه آندی افزایش و غلظت یون مس در خانه کاتدی کاهش می یابد.







