آنتروپي و تعيين پيشرفت واكنش
آنتروپي و تعيين پيشرفت واكنش
مقدار بي نظمي ذره هاي يک سيستم را آنتروپي (S) يا بي نظمي ذره اي مي نامند.
آنتروپي و پيش بيني يك واكنش 1
|
آنتروپي و تغيير آنتروپي |
|
مقدار بي نظمي ذره هاي يک سيستم را آنتروپي (S) يا بي نظمي ذره اي مي نامند. تغيير آنتروپي سيستم را ميتوان به صورت زير نمايش داد: |
 |
|
نکته: آنتروپي (S) نيز مانند انرژي دروني (E) و آنتالپي (H) يک تابع حالت است يعني فقط به بي نظمي آغازي و پاياني هر تغيير بستگي دارد. |
|
نقش آنتروپي در تعيين جهت پيشرفت واکنش هاي شيميايي |
|
پديده هاي فيزيکي و شيميايي همواره تمايل دارند به بي نظمي بالاتر دست يابند بنابراين مي توان گفت واکنش هايي که آنتروپي آنها مثبت است |
|
نکات مهم در تشخيص بي نظمي ( آنتروپي) در يک واکنش شيميايي: |
|
1) هر چه دماي سيستم بالاتر باشد ميزان جنبش و حرکت ذره هاي ماده بيشتر خواهد بود و ميزان بي نظمي بيشتر است . |
|
مثال: بي نظمي مولکول هاي |
|
2) همواره بي نظمي، حرکت، جنبش و برخورد ذره اي در فاز جامد < مايع < گاز مي باشد. |
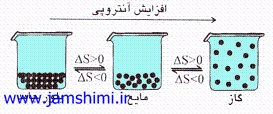 |
|
نمودار كلي تغيير آنتروپي در مقابل دما براي يک ماده به صورت زير رسم مي شود: |
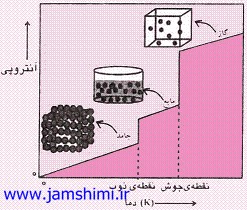 |
|
مثال: بي نظمي مولکول هاي |
|
3) چنانچه در دو طرف يک معادله شيميايي مول هاي جامد، مايع و گاز وجود داشته باشند فقط تعداد مول هاي فاز بي نظم تر يعني گاز را شمارش مي نماييم. بنابراين در چنين واکنش هايي هر طرف که تعداد مول هاي گازي ( فاز بي نظم تر) آن بيشتر است بي نظمي بيشتري خواهد داشت. |
|
همچنين اگر دو طرف يک معادله شيميايي، فازهاي جامد و مايع وجود داشته باشند فقط تعداد مول هاي فاز بي نظم تر يعني مايع را شمارش مي نماييم. بنابراين در چنين مواردي هر طرف که تعداد مول هاي فاز مايع ( فاز بي نظم تر نسبت به جامد) آن بيشتر است بي نظمي بيشتري خواهد داشت. |
|
مثال: در معادله واکنش زير هر سه فاز جامد ، مايع و گاز وجود دارد. پس فقط تعداد مول هاي فاز بي نظم تر يعني گاز را شمارش مي نماييم. |
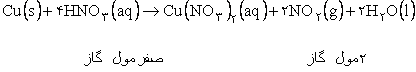 |
|
پس بي نظمي در سمت راست معادله فوق بيشتر است. |
|
4) چنانچه در دو طرف معادله يک واکنش شيميايي تعداد مول هاي فاز بي نظم تر برابر باشد هر طرف که تنوع ترکيب هاي فاز بي نظم تر آن بيشتر است اندکي بي نظمي بيشتري خواهد داشت. |
|
مثال: در معادله واکنش زير تعداد مول هاي گازي طرفين معادله برابر است: |
 |
|
چون تنوع ترکيب هاي گازي در سمت چپ معادله بيشتر است پس بي نظمي در سمت چپ معادله اندکي بيشتر خواهد بود. |
|
5) اگر فضاي بيشتري در اختيار ذره هاي يک گاز قرار بگيرد ميزان بي نظمي افزايش مي يابد چون امکان حرکت و جنب و جوش بيشتري براي ذره هاي گاز فراهم مي شود. |
|
مثال: در شکل زير پس از برداشتن صفحه جدا کننده در قسمت ظرف ذره هاي گاز که ابتدا فقط در سمت چپ قرار داشتند تمام فضاي ظرف را اشغال کرده اند پس بي نظمي در حالت (پ) بيشتر از حالت (آ) مي باشد. |
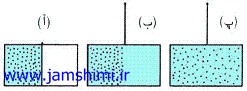 |
|
6) انحلال جامدات در مايعات اغلب با افزايش بي نظمي همراه است. |
|
مثال: انحلال يد در الکل همراه با افزايش بي نظمي است. |
|
7) انحلال مايعات در مايعات با افزايش بي نظمي همراه است. |
|
مثال: انحلال الکل معمولي در آب همراه با افزايش بي نظمي است. |
|
8) انحلال گازها در مايعات با کاهش بي نظمي همراه است. |
|
مثال: انحلال گاز اکسيژن در آب همراه با کاهش بي نظمي است. |
|
به طور کلي مي توان گفت که انحلال جامد و مايع در مايع با افزايش بي نظمي و انحلال گاز در مايع يا جامد با کاهش بي نظمي همراه است. |
|
نقش آنتالپي در تعيين جهت پيشرفت واکنش هاي شيميايي |
|
به طور کلي مي توان گفت واکنش هايي که در آنها انرژي فرآورده ها از انرژي واکنش دهنده ها پايين تر است و يا واکنش هايي که گرماده هستند پيشرفت خوبي دارند و چون بيشتر واکنش ها در فشار ثابت انجام مي شوند مي توان گفت واکنش هايي که آنتالپي آنها منفي است يکي از نشانه هاي پيشرفت خود به خودي را دارند بنابراين واکنش هاي شيميايي همواره تمايل دارند به سطح انرژي پايين تر ( حداقل انرژي) دست يابند. |
|
در يک واکنش شيميايي هر طرف که نماد q (گرما) وجود داشته باشد سطح انرژي پايين تري خواهد داشت. مثال: |
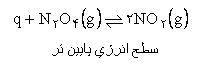 |
|
شناسايي واکنش هاي خود به خودي و غير خود به خودي |
|
هر واکنش شيميايي و يا هر تغيير ديگر به طور طبيعي ميل دارد در آن سويي خود به خود پيش برود که به سطح انرژي پايين تر يا حداقل انرژي |
|
1) واکنش هايي که گرماده بوده و با افزايش بي نظمي همراهند. |
|
اين گونه واکنش ها هميشه خود به خودي هستند. |
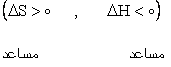 |
|
2) واکنش هايي که گرماگير بوده و با کاهش بي نظمي همراهند. |
|
اين واکنش ها هرگز خود به خودي انجام نمي شوند. |
 |
|
3) واکنش هايي که گرماده بوده و با کاهش بي نظمي همراهند. |
|
در اين موارد هر چه دما پايين تر باشد واکنش بهتر صورت مي گيرد به طوري که اگر گرما به اندازه ي کافي پايين باشد واکنش خود به خودي مي شود. |
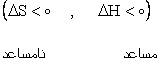 |
|
4) واکنش هايي که گرماگير بوده و با افزايش بي نظمي همراهند |
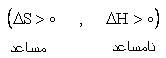 |
|
در اين موارد هر چه دما بالاتر باشد واکنش بهتر صورت مي گيرد به طوري که اگر دما به اندازه کافي بالا باشد واکنش خود به خودي مي شود. |




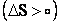 يکي از نشانه هاي پيشرفت خود به خودي را دارند.
يکي از نشانه هاي پيشرفت خود به خودي را دارند.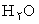 در آب 80 درجه سانتيگراد بيش از آب
در آب 80 درجه سانتيگراد بيش از آب 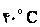 مي باشد.
مي باشد.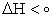 و آنتروپي بالاتر يا حداكثر بي نظمي
و آنتروپي بالاتر يا حداكثر بي نظمي 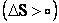 برسد. به بيان ديگر گرمادهي و افزايش آنتروپي عامل هايي هستند که شرايط خود به خود انجام شدن واکنش هاي شيميايي و ديگر رويدادهاي مادي را تامين مي کنند. بدين ترتيب 4 حالت مختلف را مي توان براي واکنش هاي فيزيکي و شيميايي درنظر گرفت.
برسد. به بيان ديگر گرمادهي و افزايش آنتروپي عامل هايي هستند که شرايط خود به خود انجام شدن واکنش هاي شيميايي و ديگر رويدادهاي مادي را تامين مي کنند. بدين ترتيب 4 حالت مختلف را مي توان براي واکنش هاي فيزيکي و شيميايي درنظر گرفت.



