پیش گویی خودبه خودی بودن یا نبودن واکنش بدون نیاز به محاسبه انرژی آزاد گیبس
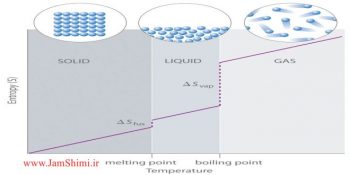
برای پیش گویی خود به خودی انجام شدن یک واکنش شیمیایی می توان از انرژی آزاد گیبس استفاده کرد.اما در این جا بدون محاسبه انرژی آزاد گیبس نیز می توان این مورد را پیش بینی نمود.همان طور که می دانیم دو عامل در خودبه خودی بودن واکنش نقش دارند
- تغییرات آنتالپی (منفی = مساعد)
- تغییرات آنتروپی (مثبت = مساعد)
اگر هر دو عامل مساعد باشند (آنتالپی منفی، آنتروپی مثبت)، واکنش در هر دمایی در جهت نوشته شده خودبخودی است (در جهت برگشت در هر دمایی غیرخودبه خودی است).
اگر هر دو عامل نامساعد باشد (آنتالپی مثبت، آنتروپی منفی)، واکنش در هر دمایی در جهت نوشته شده غیرخودبه خودی است (در جهت برگشت در هر دمایی خودبخودی است).
اگر هر دو عامل تغییرات آنتالپی و آنتروپی مثبت باشند (آنتالپی=نامساعد، آنتروپی= مساعد)؛ واکنش در دمای بالا خودبه خودی است.
اگر هر دو عامل تغییرات انتالپی و آنتروپی منفی باشند (آنتالپی=مساعد، آنتروپی = نامساعد)؛ واکنش در دمای پایین خودبه خودی است.