نکات طبقه بندی شدی تعادلها ی شیمیایی
نکات طبقه بندی شدی تعادلها ی شیمیایی نکات طبقه بندی شدی تعادلها ی شیمیایی شیمی پیشدانشگاهی را در ادامه مطلب مطالعه نمایید
|
ثابت تعادل : |
|
در واکنش های تعادلی می توان هر یک از واکنش های رفت و برگشت را به صورت یک واکنش بنیادی و یک مرحله ای در نظر گرفت پس داریم : |
 |
|
چون در حالت تعادل |
 |
|
در دمای ثابت |
|
به این رابطه عبارت ثابت تعادل گفته می شود. |
 |
|
به عبارت بهتر برای یک واکنش تعادلی در یک دمای معین نسبت حاصل ضرب غلظت فراورده ها هر یک به توان ضریب استوکیومتری به حاصل ضرب غلظت واکنش دهنده ها هر یک به توان ضریب استوکیومتری همواره مقدار ثابتی است. |
|
نکته : توجه داشته باشید که عبارت ثابت تعادل بر اساس معادله های سرعت واکنش های رفت و برگشت نوشته می شود از طرفی سرعت نیز خود وابسته به غلظت است از آنجا که غلظت مواد جامد (s) و مایع (l) همواره ثابت است می توانیم از نوشتن غلظت آن ها در رابطه تعادل خودداری کنیم. |
|
دقت داشته باشید که ثابت تعادل واحد ثابتی ندارد و برای تعیین واحد آن باید عبارت ثابت تعادل برای واکنش مورد نظر را نوشته و واحد غلظت هر ماده را |
|
تغییر ثابت تعادل |
|
ثابت تعادل یک واکنش نشان دهنده غلظت فراورده ها به واکنش دهنده ها و معیاری از پیشرفت واکنش تعادلی است زیرا هر چه این ثابت تعادل بزرگتر باشد بیان کننده این مطلب است که مقدار بیشتری از واکنش دهنده ها به فراورده ها تبدیل شده است. |
|
با توجه به مقدار عددی K چهار حالت مختلف را می توان برای واکنش های تعادلی در نظر گرفت : |
|
1- اگر مقدار عددی K بزرگ باشد یعنی (عدد یک رقمی مثبت) K=10 مثل |
|
2- اگر مقدار عددی K کوچک باشد یعنی (عدد یک رقمی منفی) K=10 مثل |
|
3- اگر مقدار عددی K بسیار بزرگ باشد یعنی (عدد دو رقمی مثبت) K=10 مثل |
|
4- اگر مقدار عددی K بسیار کوچک باشد یعنی (عدد دو رقمی منفی) K=10 واکنش رفت تقریبا انجام نمی شود و مقدار محصول بسیار ناچیز است. |
|
برای پیش بینی جهت پیشرفت واکنش کافی است رابطه ثابت تعادل را برای واکنش نوشته و آنرا با علامت Q نشان دهیم Q را خارج قسمت واکنش گویند اگر : |
|
1-Q=K باشد واکنش در حالت تعادل قرار دارد. |
|
2- Q>K باشد واکنش در جهت برگشت پیشرفت می کند تا به تعادل برسد. |
|
3- Q |
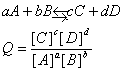 |
|
دقت کنید که K تنها برای واکنش در حال تعادل محاسبه می شود اما Q برای هر دو واکنش برگشت پذیری قابل محاسبه است. |
|
نکات مهم در رابطه با ثابت تعادل : |
|
1-مقدار ثابت تعادل برای واکنش رفت و برگشت عکس یکدیگر است. |
 |
|
2- هر گاه ضرایب استوکیومتری معادله یک واکنش تعادلی را در عدد ثابتی ضرب کنیم ثابت تعادل به توان آن عدد می رسد : |
 |
|
3- هر گاه یک واکنش تعادلی مجموع دو واکنش تعادلی دیگر باشد , ثابت تعادل آن برابر با حاصل ضرب ثابت تعادل های قبلی خواهد بود. |
 |
|
ثابت تعادل یک ویژگی ترمودینامیکی است و سرعت برقراری تعادل و زمان مورد نیاز برای رسیدن به حالت تعادل یک ویژگی سینتیکی است . یعنی گاه ثابت تعادل واکنش بسیار بزرگ است اما در دمای مورد نظر سرعت رسیدن واکنش به تعادل بسیار کوچک باشد. |
|
از طرفی تنها عامل موثر بر ثابت تعادل دما است یعنی ثابت تعادل یک واکنش در دماهای مختلف متفاوت است. |

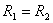 است بنابراین :
است بنابراین : مقادیر ثابتی هستند پس نسبت آنها نیز مقایر ثابتی هستند
مقادیر ثابتی هستند پس نسبت آنها نیز مقایر ثابتی هستند  و به آن ثابت تعادل (K) می گوئیم.
و به آن ثابت تعادل (K) می گوئیم. در نظر می گیریم سپس با ساده کردن واحد غلظت های مولی در صورت و مخرج به واحد ثابت تعادل می رسیم.
در نظر می گیریم سپس با ساده کردن واحد غلظت های مولی در صورت و مخرج به واحد ثابت تعادل می رسیم. واکنش رفت پیشرفت خوبی دارد و غلظت فراورده ها از واکنش دهنده ها بیشتر است در این صورت گفته می شود تعادل در سمت راست یا سمت فراورده ها قرار دارد.
واکنش رفت پیشرفت خوبی دارد و غلظت فراورده ها از واکنش دهنده ها بیشتر است در این صورت گفته می شود تعادل در سمت راست یا سمت فراورده ها قرار دارد. واکنش رفت پیشرفت خوبی ندارد و غلظت فراورده ها از واکنش دهنده ها کمتر است در این صورت گفته می شود تعادل در سمت چپ یا سمت واکنش دهنده ها قرار دارد.
واکنش رفت پیشرفت خوبی ندارد و غلظت فراورده ها از واکنش دهنده ها کمتر است در این صورت گفته می شود تعادل در سمت چپ یا سمت واکنش دهنده ها قرار دارد. واکنش تا مرز کامل شدن پیش می رود و یک یا چند واکنش دهنده به طور کامل مصرف می شوند و می توان با بهره گیری از اصول استوکیومتری محاسبه های کمی را برای این واکنش انجام داد.
واکنش تا مرز کامل شدن پیش می رود و یک یا چند واکنش دهنده به طور کامل مصرف می شوند و می توان با بهره گیری از اصول استوکیومتری محاسبه های کمی را برای این واکنش انجام داد.




