مفهوم مول

مفهوم مول برای محاسبات کمی نمی توان از یک عدد مولکول یا اتم استفاده کرد . چراکه اتم ها و مولکولها بسیار کوچکند و جرم آنها بسیار ناچیز …. پس می توانیم کمیتی به نام مول بکار ببربم همانطور که شما برای خرید نوشابه در هنگام میهمانی ، هیچ موقع نمی گویید : 48 تا نوشابه بدهید و از کلمه صندوق استفاده می کنید (2 صندوق نوشابه ) …. برای مولکول ها و اتم ها از مول استفاده می کنیم و می گوئیم : 2 مول اتم یا 3 مول مولکول و غیره …… یک مول از هر ذره = 23 10 × 022/6 ذره به عدد بالا عدد آووگادرو می گوئیم برای تبدیل مول به گرم : مول را در جرم مولی ماده ضرب می کنیم
برای تبدیل گرم به مول : گرم ماده را بر جرم مولی آن تقسیم می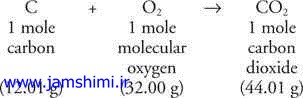 کنیم برای تبدیل مول به تعداد : مول را در عدد آووگادرو ضرب می کنیم برای تبدیل تعداد به مول : تعداد را بر عدد آووگادرو تقسیم می کنیم منظور از جرم مولی : مجموع جرم های اتمی ، اتمهای سازنده ماده است جرم مولی گاز هیدروژن : 1×2=2 جرم مولی آب : (1×2)+16=18 سوال : 2 مول آب چند گرم است ؟ جواب : 32=18*2 سوال : 6/3 گرم آب چند مول است ؟ جواب : = 2/0 سوال : 23 10 * 01/3 مولکول آب چند مول است ؟ جواب : = 0.2 قانون پایستگی جرم : در یك واكنش شیمیایی هیچ اتمی از بین نمی رود و مجموع جرم های اتم های مواد واكنش دهنده با مجموع جرم های اتم های مواد فرآورده برابر است.( درست مثل دو كفه ترازو ) معادله واكنش شیمیایی : برای نشان دادن تغییرات شیمیایی بكار می رود می دانید كه به تغییری ، تغییر شیمیایی می گوئیم كه در آن ماهیت مواد عوض شود پس موادی با هم برخورد می كنند و واكنش داده و مواد دیگری را به وجود می آورند در یك معادله شیمیایی : الف) مواد اولیه یا واكنش دهنده را سمت چپ می نویسیم ب) مواد حاصله یا فرآورده را در سمت راست می نویسیم مثل واكنش تهیه آب : 2H2 + O2 H2-O معادله های زیر را طوری موازنه کنید و ضرایب مناسب بگذارید که قانون پایستگی رعایت شده باشد N2 + H2 > NH3 Al + Cl2 > AlCl3 Mg + N2 > Mg3N2 Zn + HCl > ZnCl2 + H2
کنیم برای تبدیل مول به تعداد : مول را در عدد آووگادرو ضرب می کنیم برای تبدیل تعداد به مول : تعداد را بر عدد آووگادرو تقسیم می کنیم منظور از جرم مولی : مجموع جرم های اتمی ، اتمهای سازنده ماده است جرم مولی گاز هیدروژن : 1×2=2 جرم مولی آب : (1×2)+16=18 سوال : 2 مول آب چند گرم است ؟ جواب : 32=18*2 سوال : 6/3 گرم آب چند مول است ؟ جواب : = 2/0 سوال : 23 10 * 01/3 مولکول آب چند مول است ؟ جواب : = 0.2 قانون پایستگی جرم : در یك واكنش شیمیایی هیچ اتمی از بین نمی رود و مجموع جرم های اتم های مواد واكنش دهنده با مجموع جرم های اتم های مواد فرآورده برابر است.( درست مثل دو كفه ترازو ) معادله واكنش شیمیایی : برای نشان دادن تغییرات شیمیایی بكار می رود می دانید كه به تغییری ، تغییر شیمیایی می گوئیم كه در آن ماهیت مواد عوض شود پس موادی با هم برخورد می كنند و واكنش داده و مواد دیگری را به وجود می آورند در یك معادله شیمیایی : الف) مواد اولیه یا واكنش دهنده را سمت چپ می نویسیم ب) مواد حاصله یا فرآورده را در سمت راست می نویسیم مثل واكنش تهیه آب : 2H2 + O2 H2-O معادله های زیر را طوری موازنه کنید و ضرایب مناسب بگذارید که قانون پایستگی رعایت شده باشد N2 + H2 > NH3 Al + Cl2 > AlCl3 Mg + N2 > Mg3N2 Zn + HCl > ZnCl2 + H2


