آموزش شیمی 3
مفهوم ضریب وانتهوف
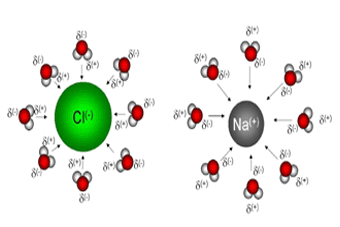
مفهوم ضریب وانتهوف وقتی یک ترکیب یونی مثل NaCl در آب حل میشود شبکه بلوری آن متلاشی شده و یون های سازنده بلور در محلول پراکنده می شوند . اما باز هم بین این یون ها جاذبه وجود دارد که موجب میشود یون ها در محلول الکترولیت کاملا مستقل نباشند.جفت یون نامی است که به این یونها در محلول الکترولیت داده شده است.ضریب وانتهوف نشان دهنده این است که در یک محلول الکترولیت چه نسبتی از کل یون ها رفتار مستقل دارند . به عنوان مثال وقتی نمک NaCl در آب حل می شود در حالت حدی خود دو مول یون تولید می کند ، اما ضریب وانتهوف ( i ) برای محلول 1/0 مولار آن برابر 87/1 می باشد . که نسبت به حالت حدی 2 کمتر است . این مقدار اختلاف ناشی از تاثیر یون ها بر یک دیگر در محلول می باشد.
ضریب وانتهوف در یک محلول به دو عامل بستگی دارد که عبارتند از :
1- غلظت محلول : هر چه محلول غلیظ تر شود تراکم یون ها بیشتر شده و تاثیر آن ها بر یک دیگر بیشتر خواهد بود ، بنابر این با افزایش غلظت محلول ضریب وانتهوف از حالت حدی خود کمتر میشود . به عنوان مثال ضریب وانتهوف برای محلول های 1/0 ، 01/0 و 001/0 مولار آن به ترتیب 87/1 ، 94/1 و 97/1 می باشد .
2- دما : با افزایش دمای محلول بر میزان جنبش یون ها افزوده می شود که موجب کاهش تاثیر آن ها بر یکدیگر می شود . بنابر این با افزایش دما ضریب وانتهوف افزایش یافته و به حالت حدی خود نزدیک تر میشود .
لینک کوتاه مطلب
برای کپی کلیک کنید