انرژی درونی و آنتالپی و مقایسه تغییرات آن ها
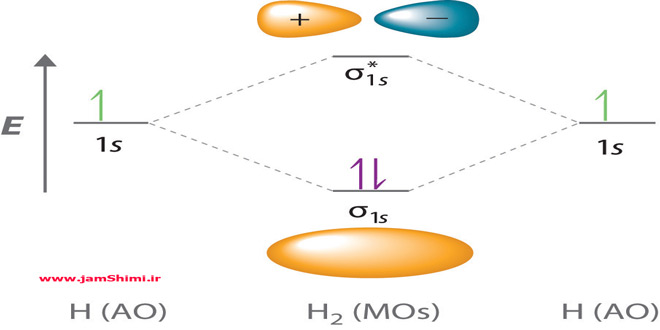
انرژی درونی Internal energy و آنتالپی Enthalpy دو تا از مفاهیم مهم ترمودینامیک می باشند که در مورد سامانه ها و سیستم ها و اجسام به کار می روند. انرژی کل یک سیستم، شامل انرژی های جنبشی، پتانسیل و درونی می باشد. منظور از انرژی جنبشی، انرژی ماکروسکوپی و مربوط به حرکت تمام قسمت های سیستم، با سرعت یکسان نسبت به یک مبنای مرجع (نقطه – مکان بیرونی) است. منظور از انرژی پتانسیل، انرژی ماکروسکوپی است که سیستم در نتیجه تغییر ارتفاع در میدان گرانش کسب کرده است. منظور از انرژی درونی، مجموع تمام انرژی های میکروسکوپی سیستم است. در ادامه از جم شیمی به بررسی انرژی درونی و آنتالپی و مقایسه تغییرات آن ها می پردازیم.
یعنی انرژی کل برای هر سامانه برابر است با :
E=KE+PE+U
KE= انرژی جنبشی سامانه نسبت به یک مرجع بیرونی
PE= انرژی پتانسیل سامانه نسبت به یک مرجع بیرونی
U= انرژ ی درونی سامانه
از آنجا که ما در ترمودینامیک پایه (غیر مهندسی) با انرژی های جنبشی و پتانسیلی که نسبت به یک مرجع بیرونی (مبنای مرجع) اندازه گرفته می شوند کاری نداریم و همچنین با سامانه های ساکن سروکار داریم پس انرژی های PE و KE صفر هستند. به این ترتیب انرژی کل یک سامانه(ساکن) برابر با انرژی درونی می شود.
سوال: آنتالپی یک سامانه چگونه از رابطه H=u+pv حاصل می شود؟
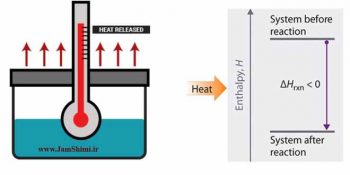
اگر u انرژی کل یک سامانه است پس pv که به آن اضافه می شود به انرژی سامانه افزوده نمی گردد ؟ منظور از انرژی درونی، تمام انواع انرژی های میکروسکوپیک یک سیستم است یعنی مجموع انرژی های جنبشی اجزای سازنده (مولکول یا اتم) و همچنین انرژی های مربوط به نیروها بین مولکولی و برهمکنش های درون سیستمی ذره های سازنده سیستم (انرژی شیمیایی)، انرژی هسته ای، الکترونی و… آنتالپی آن دسته از صورت های انرژی درونی یک سیستم است که: تغییرات آن ها را در حالتی می توان حساب کرد که تنها کار انجام شده توسط سیستم (یا روی سیستم) از نوع تغییر حجم باشد.
سوال دوم اینکه آیا هر سامانه u دارد؟ آیا هر سامانه H دارد؟ بله هر سامانه u دارد. هر سامانه تنها زمانی H دارد که کار ناشی از تغییر حجم برای آن سامانه (یا روی آن سامانه) انجام شود. برای اندازه گیری H از تغییرات برخی پارامترهای این معادله H=u+pv استفاده می کنیم.
اما در یک فرایند شیمیایی، برای سیستم های جامد و مایع و حتی گاز ( به شرط آن که حجم سیستم تغییر نکند) تغییرات PV تقریباً صفر است.
پس می توانیم بگوئیم آنتالپی و انرژی درونی این سیستم ها برابر هستند. و چون انرژی درونی برای سیستم های ساکن، برابر با انرژی کل است پس می توانیم بگوئیم که آنتالپی چنین سیستم هایی برابر با انرژی کل است.
بیان چنین جمله ای در سطح دبیرستان، به دو دلیل زیر، نوعی کلی گویی است که می تواند باعث کج فهمی شود:
1- در ترمودینامیک یک مفهوم عام و کلی برای آنتالپی نداریم. بلکه همیشه به دنبال واژه آنتالپی، باید پسوندهایی مانند سوختن، تشکیل، تبخیر، ذوب و … نیز همرا شود. آنتالپی سوختن، آنتالپی تشکیل و… در حالیکه در جمله ذکر شده، از اصطلاح عام آنتالپی استفاده شده است.
2- از آنجا که اندازه گیری آنتالپی مشروط به رخدادن فرایندی است که در آن کار ناشی از تغییر حجم(در فشار ثابت) انجام گیرد. پس گفتن اینکه، همه مواد دارای آنتالپی هستند این تصور را بوجود می آورد که آنتالپی یک خاصیت ذاتی سیستم است که می توان آن را برای یک سیستم ساکن و ثابت( بودن تغییر و انجام فرایند) محاسبه کرد.