آموزش شیمی 2
نکات تعیین عدد اکسایش عنصرها
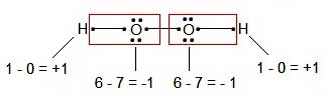
نکات تعیین عدد اکسایش عنصرها
به بار الکتریکی ظاهری نسبت داده شده به هر اتم، با فرض یونی بودن پیوند ها، عدد اکسایش می گوییم.
برای تعیین عدد اکسایش عنصر ها باید به قوانین زیر توجه کنیم:
2- عدد اکسایش فلوئور در ترکیب با سایر عنصر ها همواره برابر 1- است.
زیرا فلوئور الکترونگاتیو ترین عنصر است و همواره در پیوند با سایر عنصر ها، الکترون ها را به سمت خود می کشد.
3- عدد اکسایش اکسیژن معمولاً برابر 2- است.
اما در H2O2 برابر 1-، در O2F2 برابر 1+، در OF2 برابر 2+ و در HOF صفر است.
4- عدد اکسایش هیدروژن معمولاً برابر 1+ است.
اما در هیدرید های فلزی (مانند KH یا CaH2) عدد اکسایش هیدروژن برابر 1- است.
5- عدد اکسایش فلز ها همواره مثبت و برابر ظرفیت آن ها است.
به عنوان مثال پتاسیم جزو گروه اول است و ظرفیت آن همواره برابر یک است. پس عدد اکسایش آن نیز همواره 1+ است. و یا در Fe2(SO4)3، ظرفیت آهن برابر سه است پس عدد اکسایش آن نیز برابر 3+ است.
6- هالوژن ها (Cl، Br یا I) در ترکیب با عناصری که الکترونگاتیوی کمتری دارند دارای عدد اکسایش 1- هستند.
زیرا هالوژن ها دارای هفت الکترون در لایه والانس خود هستند پس تمایل دارند که با گرفتن یک الکترون به آرایش الکترونی گاز نجیب هم دوره ی خود برسند. برای تمونه در ترکیب هایی مانند S2Cl2 و -AlBr4 عدد اکسایش کلر و برم برابر 1- است.
7- عدد اکسایش یون های تک اتمی برابر با بار یون است.
به عنوان مثال عدد اکسایش آهن در +Fe3 برابر 3+ و عدد اکسایش گوگرد در –S2 برابر 2- است.
8- مجموع عدد اکسایش عنصر ها در یک مولکول برابر صفر و در یک یون برابر با بار یون است.
با توجه به این نکته برای تعیین عدد اکسایش یک عنصر در یک ترکیب معین می توان یک معادله تنظیم نمود و عدد اکسایش عنصر مورد نظر را به دست آورد. به عنوان مثال در فسفریک اسید، عدد اکسایش هیدروژن و اکسیژن به ترتیب برابر 1+ و 2- است.
لینک کوتاه مطلب
برای کپی کلیک کنید





