نكته هاي كنكوري شیمی قسمت 2
نكته هاي كنكوري شیمی
شیمی 2 – آرایش الکترونی عناصر واسطه کنکوری
– در بین عناصر شماره 1 تا 36 عناصر 21 تا 30 عنصر واسطه بوده و تراز 3d در انها پر می شود و مابقی عنصر اصلی هستند .
– در عناصر واسطه 21 تا 30 ( بجز کروم و مس که آرایش استثنا دارند ) تعداد الکترون تراز 3d برابر با یکان عدد اتمی آنهاست و تراز 4s آنها نیز پرشده است . مثلا آهن با عدد اتمی 26 در تراز 3d خود 6 الکترون و در تراز 4s خود 2 الکترون دارد .
ساختار اتم
…………………………………………..
شیمی 2 – جرم اتم بر حسب amu
هر amu جرمی معادل یک نوترون یا تقریبا یک پروتون دارد ، بنابراین جرم هر اتم بر حسب amu تقریبا برابر با عدد جرمی آن اتم است . مثلا عدد جرمی اتم اکسیژن معمولی 16 است و جرم هر اتم آن 16 amu می باشد .
ساختار اتم
…………………………………………..
شیمی 2 – آرایش الکترونی عناصر 31 تا 36
این عناصر همگی در بلوک P قرار داشته و جزء عناصر اصلی می باشند . آرایش الکترونی همگی آنها به 4p ختم شده و تراز 3d و 4s انها پرشده است. تعداد الکترون تراز 4p آنها برابر با یکان عدد اتمی آنهاست . مثلا عنصر شماره 35 در تراز 4p خود 5 الکترون دارد .
ساختار اتم
…………………………………………..
…………………………………………..
شیمی 2 – ترازهای فرعی هر دوره جدول تناوبی
بطور کلی در هر دوره جدول ترازهای فرعی زیر در حال پرشدن می باشند :
ns , (n-2)f , (n-1)d , np
که در آن n شماره دوره جدول است . مثلا در دوره 5 (n=5 ) ترازهای 5s , 4d , 5p به ترتیب پر میشوند . ( چون تراز 3f وجود ندارد آنرا نمینویسیم )
ساختار اتم
…………………………………………..
پیش دانشگاهی – رادیکال
اتم یا گروهی از اتمها که دارای یک یا چند اربیتال تک الکترونی می باشند را رادیکال می گویند . رادیکالها ذراتی بسیار فعال و واکنش پذیر می باشند که به سرعت در واکنشهای شیمیایی شرکت می کنند
سینیتیک شیمیایی
…………………………………………..
پیش دانشگاهی – سرعت واکنش
افزایش دما بر سرعت واکنشهایی که انرژی فعالسازی بیشتری دارند ، تاثیر بیشتری دارد . بطوریکه هر چه Ea یک واکنش بزرگتر باشد ، افزایش دما سرعت آنرا بیشتر افزایش می دهد .
سینیتیک شیمیایی
…………………………………………..
پیش دانشگاهی – سرعت واکنش
در یک واکنش ، ماده ای که کوچکترین ضریب استوکیومتری را در معادله شیمیایی دارد ، کمترین سرعت و ماده ای که بزرگترین ضریب استوکیومتری را دارد بیشترین سرعت تولید یا مصرف را دارد .
در واکنش زیر ماده A کمترین سرعت مصرف و ماده D بیشترین سرعت تولید را دارد .
A + 2B ——>2C + 3D
سینیتیک شیمیایی
…………………………………………..
پیش دانشگاهی – مواد جامد و مایع خالص
سرعت مصرف یا تولید مواد جامد یا مایع خالص را در واکنشهای شیمیایی نمیتوان بر حسب مولار بر زمان ( M/S) تعیین کرد . زیرا غلظت مواد جامد و مایع خالص ثابت بوده و در طول انجام واکنش تغییر نمی کنند . سرعت مصرف یا تولید این مواد را بایستی بر حسب مول بر زمان (mol/S) تعیین کرد .
سینیتیک شیمیایی
…………………………………………..
پیش دانشگاهی – انرژی فعالسازی
انرژی فعالسازی ( رفت یا برگشت ) همواره مقداری مثبت است . در صورتیکه آنتالپی واکنش میتواند مثبت یا منفی باشد .
سینیتیک شیمیایی
…………………………………………..
پیش دانشگاهی – واکنشهای برگشت پذیر
واکنشهای برگشت پذیر در یک سیستم شیمیایی بسته ، معمولا بطور کامل انجام نمی شوند . زیرا قبل از کامل شدن ، واکنش به تعادل رسیده و غلظت مواد واکنش ثابت می شود .
تعادل شیمیایی
…………………………………………..
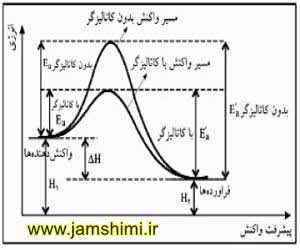
پیش دانشگاهی – پیچیده فعال
سطح انرژی پیچیده فعال ( کمپلکس فعال ) همواره بیشتر از سطح انرژی مواد واکنش دهنده و مواد فراورده است و در ساختار آن تمامی پیوندها ضعیف نمی شوند ، بلکه فقط پیوندهایی که قرار است تشکیل یا شکسته شوند سست و ضعیف می شوند که انها را بصورت نقطه چین نشان می دهند .
سینیتیک شیمیایی
| شیمی 2 – انرژی یونش |
| هر عنصر به تعداد الکترونهایش ( عدد اتمی ) دارای انرژی یونش است .
– انرژی های یونش متوالی یک عنصر همواره در حال افزایش است . ( IEn> … >IE3>IE2>IE1 ) – در هر گروه از بالا به پایین انرژی نخستین یونش کاهش می یابد . – در هر دوره از چپ به راست انرژی نخستین یونش افزایش می یابد ، بجز در گروه 13 و 16 که کاهش می یابد . – در هر دوره جدول فلز قلیایی کمترین انرژی نخستین یونش و گاز نجیب بیشترین انرژی نخستین یونش را دارد . – در بین تمام عناصر ، هیلم بیشترین انرژی نخستین یونش و سزیم کمترین انرژی نخستین یونش را دارد. |
| ساختار اتمبا تشكر از همكار محترم آقاي مرتضي محمدي از مركز استعدادهاي درخشان |