مقایسه نقطه ذوب و جوش در ترکیب های مولکولی و ترکیبات دوتایی هیدروژن دار

در مقایسه دمای ذوب و جوش ترکیب های مولکولی باید به نکاتی توجه کرد که این نکات برای درک بهتر و سریع تر نقطه ذوب و جوش ترکیبات مولکولی مناسب می باشد.مولکول هایی که دارای پیوند هیدروژنی هستند معمولا نسبت به سایر ترکیب های مولکولی دمای ذوب و جوش بالاتری دارند زیرا پیوند هیدروژنی قوی ترین پیوند بین مولکولی محسوب می شود.
ترکیب های مولکولی که فاقد پیوند هیدروژنی هستند به جرم وحجم آنها توجه می کنیم بدین ترتیب که هرچه جرم و حجم مولکول ها بیشتر باشد نیروی واندروالسی بین مولکول ها قوی تر و نقطه ذوب و جوش آنها بیشتر است.
نقطه جوش:
I2> Br2> Cl2> F2> H2
نکته:
اگر یک مولکول قطبی و مولکول دیگر ناقطبی باشد معمولا نقطه جوش مولکول قطبی بیشتر است . البته این نکته به شرطی صدق می کند که اختلاف جرم و حجم چندان زیاد نباشد و بیشتر در مواردی استفاده می شود که اتم های مرکزی دو مولکول در یک تناوب قرار داشته باشند.
نقطه جوش:
OSC> CO2 NF3> CF4
بررسی نقطه جوش در ترکیبات دوتایی هیدروژن دار گروهای چهاردهم تا هفدهم:
گروه 17:
دمای جوش HF از سایر ترکیب های هیدروژن دار بیشتر است زیرا HF دارای پیوند هیدروژنی است. اما از HCl به بعد با افزایش جرم و حجم مولکول ها نیروی واندروالسی بین آنها قوی تر شده لذا دمای جوش افزایش می یابد.
گروه 16:
وضعیت این گروه نیز درست مانند گروه 17 است. دمای جوش H2O از سایر ترکیبات دوتایی هیدروژن دار گروه 16 بیشتر است زیرا دارای پیوند هیدروژنی است. اما از H2S به بعد با افزایش جرم و حجم مولکول ها نیروی واندروالسی بین مولکولها قوی تر شده لذا دمای جوش افزایش می یابد.
گروه 15:
وضعیت این گروه نیز تا حدودی مانند گروه 16 و 17 است. دمای جوش NH3 از سایر ترکیبات دوتایی هیدروژن دار گروه 15 بیشتر است زیرا دارای پیوند هیدروژنی است. اما از PH3 به بعد با افزایش جرم و حجم مولکول ها نیروی واندروالسی بین مولکول ها قوی تر شده لذا دمای جوش افزایش می یابد.
گروه 14:
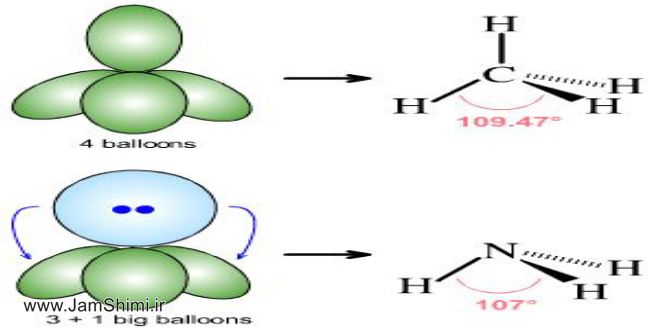
وضعیت این گروه با سه گروه قبلی متفاوت است زیرا CH4 بر خلاف NH3 ، HF و H2O فاقد پیوند هیدروژنی است لذا در این گروه از بالا به پایین با افزایش جرم و حجم مولکول ها نیروی واندروالسی قوی تر شده و در نتیجه دمای جوش به طور منظم افزایش می یابد.
نکته:
پیوند هیدروژنی در HF نسبت به H2O و در H2O نسبت به NH3 قوی تر است.