مقایسه طیف نشری خطی ایزوتوپ های یک عنصر
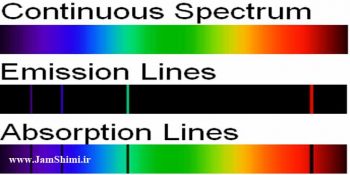
مقایسه طیف نشری خطی ایزوتوپ های یک عنصر برای مثال هیدروژن سه ایزوتوپ دارد آیا طیف نشری خطی این سه ایزوتوپ با یکدیگر مشابه است؟ یا اکسیژن که دارای سه ایزوتوپ می باشد نیز می تواند طیف نشری خطی ایزوتوپ های آن با یکدیگر مشابه و یکسان باشند؟ در ادامه از جم شیمی به بررسی تفاوت های طیف نشری خطی ایزوتوپ های عناصر می پردازیم.
از آنجا که جرم اتمی ایزوتوپ های یک عنصر با هم تفاوت دارند ، طول موج خطوط طیفی ایجاد شده، اندکی تفاوت دارد. برای محاسبه ی طول موج این خطوط می توان از رابطه ی زیر استفاده کرد:
1/λ = R (1/n12 – 1/n22)
در واقع در رابطه های طیفی، استفاده از وارونه طول موج یا عدد موجی مناسب تر می باشد. در فرمول بالا ، n1 و n2 عددهای صحیح و نماینده ترازهای انرژی می باشند. R ثابت ریدبرگ است. R برای دوتریم اندکی بزرگ تر از هیدروژن است و بنا به رابطه ذکر شده ، خطوط طیفی دوتریم نسبت به هیدروژن، کمی به سمت طول موج های کوتاه تغییر مکان و شیفت نشان می دهند. بنابراین و بر همین اساس به کمک طیف های اتمی وجود برخی از ایزوتوپ ها ثابت شده است. در نتیجه طیف نشری خطی ایزوتوپ های یک عنصر با یکدیگر فرق دارد.
يكي از راه های شناسايی ايزوتوپ ها ازطریق بررسی طيف متفاوت آنها می باشد. در ایزوتوپ ها، به دلیل داشتن هسته های متفاوت، میزان جاذبه ای که به لایه ها وارد می شود، متفاوت است، پس اختلاف انرژی بین لایه ها متفاوت می شود و در نتیجه در طیف نشری آن ها اندکی تفاوت مشاهده می شود. چون جرم کاهش یافته الکترون در این ایزوتوپ ها یکسان نیست، پس در ثابت ریدبرگ اثر گذاشته و باعث تفاوت هرچند جزئی در طیف این ایزوتوپ ها می شود.