دانلود جزوه کنکوری اکسایش و کاهش

دانلود جزوه کنکوری اکسایش و کاهش مایکل فارادی فیزیکدان و شیمیدان انگلیسی که کشف بنزن و تهیهی کلر مایع دز شیمی و ساخت موتور الکتریکی و دینام در فیزیک تنها بخشی از افتخارات او است، علاقهی زیادی به شیمی، الکتریسیته و رابطهی بین این دو داشت. این علاقه و تلاش فارادی باعث شد که شاخهای از علوم به نام الکتروشیمی ایجاد شود. الکترون پیوند دهندهی شیمی و الکتریسیته است.

مثال (۱) : عدد اکسایش انمی که با علامت (*) مشخص شده است را تعیین کنید.
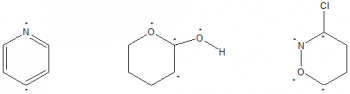
روش فوق بهترین روش برای تعیین عدد اکسایش اتمها در ترکیبهای آلی است. برای تعیین عدد اکسایش اتمها در ترکیبهای معدنی از قواعد زیر استفاده میکنیم.
۱) عدد اکسایش هر عنصر به حالت آزاد مساوی صفر است. He , N2 , O3 , P4 , S8 ,
2) عدد اکسایش برای یون تک اتمی برابر با بار آن است . Fe+2 , Cl–
3) عدد اکسایش فلزها در ترکیبها معمولا مثبت و برابر ظرفیت فلز است. K3Fe(CN)6
4) نافلزها در ترکیب با عنصرهای الکتروپوزیتیوتر از خود، همواره دارای عدد اکسایش منفی و برابر با مهمترین ظرفیت خود هستند. PCl5
5) عدد اکسایش هیدروژن در عموم ترکیبها ۱+ است، تنها در هیدریدهای فلزی عدد اکسایش هیدروژن مساوی ۱- است. H2SO4 , NaHCO3 , CH2—CH2—OSO3H NaH . CaH2
6) عدد اکسایش اکسیژن در عموم ترکیبها ( ۲- ) است. مگر در موارد مندرج در جدول زیر:
| ترکیب ( ترکیب ها ) | عدد اکسایش |
| OF2 | 2+ |
| HOF | 0 |
| پر اکسیدها:پر اکسید هیدروژن – H2O2
پراکسید فلز قلیایی – M2O2 پراکسید فلز قلیایی خاکی – MO2 |
1- |
| سوپر اکسیدها | ۵/۰- |
7) مجموع عدد اکسایش اتمهای موجود در یک ذره با بار آن ذره برابر است.
مثال ( ۲ ) : عدد اکسایش اتمی را که زیر آن خط کشیده شده است، معین کنید.
MnO42- K2Cr2O7
Na2S2O3 KClO3
مثال ( ۳ ) : عدد اکسایش گوگرد در کدام ذره با بقیه متفاوت است؟
۱) SO2 2) SF4 3) Na2SO3 4) Na2SO4
مثال ( ۴ ) : در کدام گزینه عدد اکسایش اتمی که زیر آن خط کشیده است با عدد اکسایش اتم فسفر در PO43- تفاوت دارد؟
۱) ClF5 2) N2O5 3) H2S2O7 4) HNO3
مثال (۵) : مجموع عدد اکسایش اتمهای موجود در C6H5O– کدام مقدار زیر است؟
۱) ۲- ۲) ۱- ۳) ۱+ ۴) ۲+
8) اگر مجموعهای از اتمها دارای بار مشخصی باشند، میتوان همه آنها را یک اتم با عدد اکسایش مساوی آن بار در نظر گرفت.
مثال ( ۶ ) : عدد اکسایش اتمی که زیر آن خط کشیده شده است را محاسبه کنید.
K4Fe(CN)6 (NH4)2CrO4 Fe2(SO4)3
تعریف اکسایش و کاهش :
الف) تعریف قدیمی :
مطابق این تعریف اگر مادهای در یک واکنش اکسیژن بگیرد (یا هیدروژن از دست بدهد) اکسید شده است. مادهای که اکسیژن از دست بدهد (هیدروژن بگیرد) کاهیده شده است.
به عنوان مثال V2O5 در واکنش V2O5 +2 CO → V2O3 + 2CO2 اکسیژن از دست داده و کاهیده شده است، حال آنکه کربن مونوکسید با از گرفتن اکسیژن اکسید شده است.
ب) تعریف الکترونی:
مطابق این تعریف اگر در یک واکنش عنصری الکترون بگیرد کاهیده شده است و عنصری که الکترون از دست میدهد، اکسید شده است. از آنجا که از دست دادن یا گرفتن الکترون به تنهایی رخ نمیدهد واکنشی فرضی که در آن یک عنصر تنها الکترون از دست بدهد و یا الکترون بگیرد یک نیم واکنش نامیده میشود. از جمع دو نیم واکنش به گونهای که الکترون اضافی باقی نماند، یک واکنش اکسایش – کاهش بدست میآید.
نیم واکنش اکسایش Fe → Fe2+ + 2e
نیم واکنش کاهش Cu2+ + 2e → Cu
Fe + Cu2+ → Cu + Fe2+ واکنش اکسایش – کاهش
ج) تعریف بر اساس تغییر عدد اکسایش:
اگر عدد اکسایش یک ذره در یک واکنش، افزایش یابد، اکسید شده است و اگر عدد اکسایش ذرهای کاهش یابد، کاهیده شده است.
به عنوان مثال عدد اکسایش کربن در واکنش CO + Cl2 → COCl2 افزایش یافته و این عنصر اکسید شده است. از سوی دیگر عدد اکسایش کلر کم شده و در نتیجه این عنصر کاهیده شده است.
تذکر: عنصری که اکسید میشود کاهنده است و عنصر اکسنده خود کاهیده میشود.
مثال( ۷ ) : در فرایند ۲KMnO4 → K2MnO4 + MnO2 + O2 عامل کاهنده کدام است؟
۱) MnVII+ 2) OII— ۳) O2 4) K+
اگر یک یون در محلول آبی پایدار باشد، بار آن را با اعداد عربی ( ۱, ۲, ۳ ,… ) یا اعداد هندی ( ۱, ۲, ۳, …) نمایش میدهند. ولی اگر یون به تنهایی وجود نداشته باشد، از اعداد یونانی ( I, II, III, … ) استفاده میشود.
تذکر: یونهایی که قدر مطلق بار آنها از ۳ بیشتر باشد، در محلول آبی پایدار نیستند.
واکنش اکسایش – کاهش :
فرایندی که در آن عدد اکسایش عنصرها تغییر کند، فرایند اکسایش – کاهش نامیده میشود.
مثال ( ۸ ) : کدام فرایند از نوع اکسایش – کاهش نیست؟
۱) CO + Cl2 → COCl2 2) Cl2 + NaOH → NaClO + NaCl + H2O
3) FeCl2 + CuSO4 → Fe2(SO4)3 + CuCl ۴) FeS + HCl → FeCl2 + H2S
مثال ( ۹ ) : در کدام گزینه تعریف اکسایش – کاهش بر اساس اکسیژن و هیدروژن با تعریف آن بر اساس عدداکسایش منطبق نیست؟
۱) H2(g) + O2(g) → H2O(g) ۲) H2(g) + Na(l) → NaH(s)
3) NO2(g) + CO(g) → NO(g) + CO2(g) ۴) Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
مثال ( ۱۰ ) : در کدام گزینه اکسیژن عامل کاهنده است؟
۱) O2(g) + F2(g) → F2O(g) ۲) C(s) + O2(g) → CO2(g)
3) CH4(g) + O2(g) → CO2(g) + H2O(l) ۴) O2(g) + Cl2(g) → Cl2O(g)
واکنش اکسایش خودبهخود:
واکنش اکسایش خودبهخود واکنشی است که در آن یک نوع عنصر هم اکسید و هم کاهیده میشود.
مثال (۱۱) : کدام واکنش با بقیه متفاوت است؟
Fe(s) + HCl(aq) ” FeCl2(aq) + H2(g) (۱
H2O2(l) ” H2O(l) + O2(g) (۲
NO2(g) + H2O(l) ” HNO3(aq) + NO(g) (۳
Cl2(g) + NaOH(aq) ” NaCl(aq) + NaClO(aq) + H2O(l) (۴
اکسایش – کاهش ترکیبهای آلی :
هرگاه یک ترکیب آلی در یک مرحله اکسید شود، دو اتفاق روی میدهد.
۱) تعداد پیوندهای بین کربنی که حامل اتم اکسیژن است با اکسیژن یکی افزوده میشود.
۲) تعداد پیوندهای بین کربنی که حامل اتم اکسیژن است با هیدروژن یکی کم میشود.

تذکر ( ۱ ) : اگر اتمی که با اکسیژن متصل است، با هیدروژن پیوند نداشته باشد، ترکیب در فرایند اکسایش شرکت نمیکند. (خواص کاهندگی ندارد)
به همین دلیل کتونها و اسیدها ( به غیر از متانوییک اسید ) در فرایند اکسایش شرکت نمیکنند.
تذکر ( ۲ ) : میتوان اکسایش ترکیبهای آلی را دو یا سه مرحله ادامه داد:

تذکر ( ۳ ) : مخلوط نمکهای پرمنگنات و اسیدهای قوی (+ MnO4– , H ) یک اکسندهی قوی است.
تذکر ( ۴ ) : آلدهیدها و کتونها را از اکسایش الکلها تهیه میکنند.
تذکر ( ۵ ) : آلدهیدها بر خلاف کتونها کاهندههای قوی هستند.
تذکر ( ۶ ) : نوع الکلها را با توجه به تعداد اتم کربن متصل به کربن حامل گروخ OH تعیین میکنند.
بدین ترتیب از اکسایش الکلهای نوع اول یک آلدهید و از اکسایش الکلهای نوع دوم یک کتون حاسل میشود. و الکلهای نوع سوم در واکنش اکسایش شرکت نمیکنند.
مثال ( ۱۲ ) : کدام مادهی زیر در مقابل اکسایش مقاومت میکند؟
۱) اتانوییک اسید ۲) اتانال ۳) متانوییک اسید ۴) اتانول
مثال ( ۱۳ ) : کدام مادهی زیر در مقابل اکسایش مقاومت نمیکند؟
۱) پروپانون ۲) ۲-متیل-۲-بوتانول ۳) متانول ۴) پروپانوییک اسید
مثال ( ۱۴ ) : از اکسایش کدام ماده یک آلدهید تولید میشود؟
۱) ۱-بوتانول ۲) ۲-بوتانول ۳) ۲-متیل-۲-بوتانول ۴) پروپانال
مثال ( ۱۵ ) : از اکسایش کدام ماده یک کتون تولید میشود؟
۱) ۱-بوتانول ۲) ۲-بوتانول ۳) ۲-متیل-۲-بوتانول ۴) پروپانال
مثال ( ۱۶ ) : متانال را از اکسایش متانول بهوسیلهی اکسیژن در دمای بالا ( ۵۰۰oC ) و در حضور کاتالیزگر ( Fe , Ag ) تهیه میکنند. از اکسایش ۱/۶ گرم متانول چند گرم متانال تهیه میشود؟ O=16 C=12 H=1
2CH3OH(l) + O2(g) → ۲HCHO(g) + 2H2O(l)
1) 3 ۲) ۲ ۳) ۱/۵ ۴) ۱
مثال (۱۷) : تغییر عدداکسایش اتم کربن حامل گروه هیدروکسیل در واکنش زیر کدام مقدار زیر است؟
CH3CH2OH → CH3CHO
1) 0 ۲) ۱ ۳) ۲ ۴) ۳
مثال (۱۸) : تغییر عدداکسایش اتم کربن حامل گروه هیدروکسیل در واکنش زیر کدام مقدار زیر است؟
CH3CH2OH → CH3COOH
1) 5 ۲) ۴ ۳) ۳ ۴) ۲






,سلام ببخشید جواب مثالاتون کو پس
سلام
این مجموعه فعلا جواب نداره