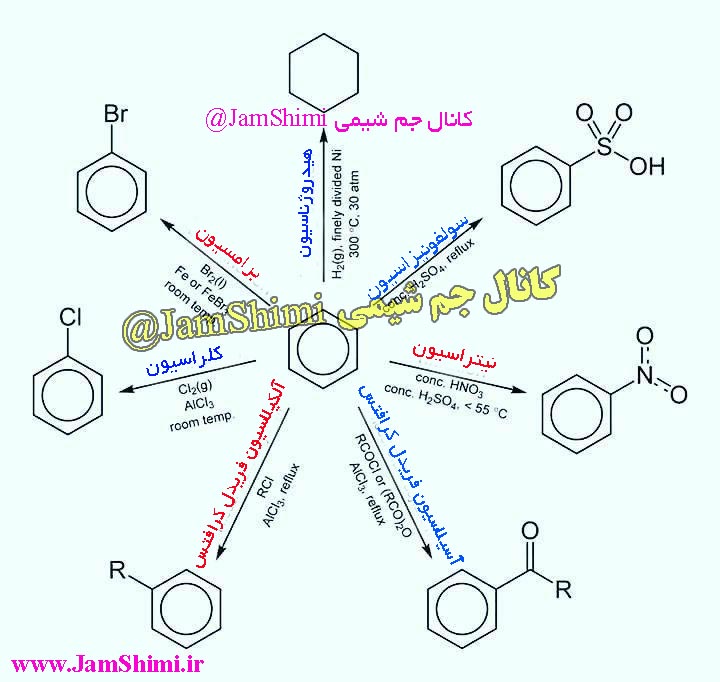
انواع واکنش های مهم حلقه بنزن

واکنش های حلقه بنزن در شیمی آلی در یک دسته بندی کلی می توان به 6 دسته کلی زیر طبقه بندی و دسته بندی نمود که عبارتند از: هالوژناسیون ، نیتراسیون ،سولفوناسیون ،فریدل کرافتس، آسیلاسیون فریدل کرافتس ،احیای بیرچ ، آلکیلاسیون فریدل کرافتس ، واکنش bromination یا برامسیون بنزن ،واکنش کلراسیون یا chlorination حلقه بنزن ، و واکنش هیدروژانسیون یا hydrogenation بنزن که در ادامه از جم شیمی مکانیسم واکنش های بنزن را مشاهده و مطالعه خواهید کرد.
1-واکنش نیتراسیون بنزن :
برای نیتراسیون بنزن واکنش در دمای ۵۰ درجه سانتیگراد صورت میگیرد و فرایند آن نمونهای از جانشینی الکتروندوستی آروماتیکی است که در آن حملهای توسط حلقهٔ پر از الکترون بنزن صورت میگیرد.
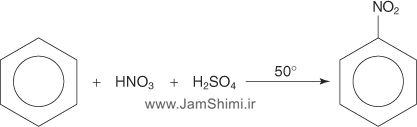
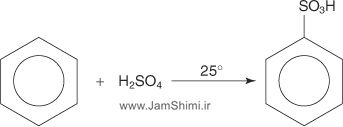
2- واکنش سولفوناسیون بنزن
به وسیله اسیدسولفوریک غلیط و حرارت میتوان طی یک واکنش جانشینی الکتروندوستی، بنزن را به بنزن یولفونیک اسید تبدیل کرد. مرحله اول شامل یک تعادل اسید و بازبین دو مولکول اسید سولفوریک میباشد که در نتیجه آن گوگردتریاکسید، SO3، که جزء الکتروندوست میباشد تولید میگردد. در مرحله بعدی SO3 به حلقه بنزن اضافه میگردد و در نهایت بنزن سولفونیک اسید تولید میگردد. این واکنش در دمای اتاق پیش نمیرود، لذا برای غلبه بر این مشکل از شکل فعالتر شده اسیدسولفوریک با نام اسیدسدلفوریک دودکننده، اولئوم، استفاده میشود. اولئوم به محلولی۷٪ از SO3در H2SO4 غلیظ گفته میشود. در این ترکیب SO3 نقش الکتروندوست را بر عهده دارد. یکی از ویژگیهای این واکنش تعادلی بودن آن است. واکنش برگشت که در حضور آب و حرارت تسریع میگردد، به واکنش سولفونزدائی معروف است. بنزنسولفونیک اسید یک اسید قوی محسوب میشود و در شراسط بازی به راحتی پروتون از دست میدهد و به آنیون بنزن سولفونات تبدیل میگردد. بنزن سولفوناتها از لحاظ تجاری نیز بسیار مهم میباشند و به طور گسترده در تولید مواد شوینده مورد استفاده قرار میگیرند. سولفوندار کردن بنزن که در موقعیت پارا یک زنجیر کربنی با ۱۰ تا ۱۴ کربن دارد (آلکیل بنزن)، آلکیل بنزن سولفونیک اسید را تولید میکند که در واکنش با باز، آنیون آلکیل بنزن سولفونات ایجاد میگردد که خاصیت پاککنندگی دارد.
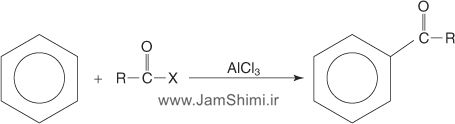
3- واکنش آسیلاسیون فریدل کرافتس بنزن
برای آلکیلدار کردن حلقه آروماتیک میتوان از واکنش آسیلدار شدن نیز استفاده کرد. آسیلدار کردن فریدل- کرافتس نسبت به واکنش آلکیلدارکردن فریدل- کرافتس چند مزیت دارد. از جمله آنکه نوآرایی کربوکاتیون در این واکنش رخ نمیدهد و همچنین در مورد ترکیبهای که گروههای NH2 و NHR دارند (باز لوئیس) نیز قابل استفاده میباشد. یون آسیلینیوم حاصل از واکنش آسیل کلرید (R-CO+X-) و اسیدلوئیس، بعنوان الکتروندوست با بنزن واکنش میدهد. حد واسط این واکنش یون آسیلیوم است که از طریق رزونانس پایدار شده نمیتواند نوآرایی کند. در این واکنش محصول حاصل یعنی فنیل کتون غیرفعالتر از بنزن است که امکان پلیآلکیله شدن از بین میرود.
4-واکنش فریدل کرافتس بنزن
واکنش فریدل–کرافتس(به انگلیسی: Friedel–Crafts reaction) مجموعهای از واکنشهای جابجایی است که طی آن یک گروه آلکیل و یا آسیل، با یکی از اتمهای هیدروژن موجود در حلقه بنزنی جابجا میشود. این واکنش در حضور کاتالیست آلومینیوم کلرید انجام میگیرد. واکنش فریدل–کرافتس به طور مشترک توسط چارلز فریدل و جیمز کرافتس و در سال ۱۸۷۷ کشف شد. حالت کلی این واکنش در شکل زیر نشان داده شده است:
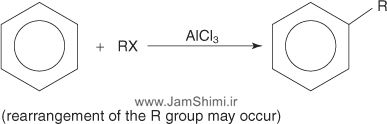
5- واکنش هالوژناسیون بنزن
وارد نمودن یون X- در ترکیبات آلی را هالوژناسیون گویند با توجه به این که عمل کننده در این واکنش ها یون منفی بوده لذا مکانیسم هالوژناسیون می تواند با سمبل SN نمایش داده شود.بر حسب این که ماده آلی مورد عمل دارای چه خصوصیاتی باشد شرایط هالوژناسیون متناوب است مثلا در هالوژناسیون الکل ها و تهیه آلکیل هالیدها مکانیسم با توجه نوع الکل (نوع اول-نوع دوم-نوع سوم) مکانیسم های متفاوتی را شامل می شود. مکانیسم کلی واکنش هالوژناسیون به شرح زیر می باشد.

6- واکنش احیای بیرچ در بنزن
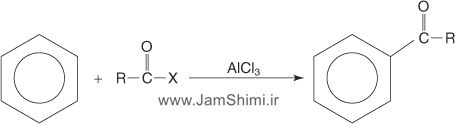
شماتیک و دیاگرام کلی واکنش های بنزن را می توان به صورت کلی زیر خلاصه نمود