آموزش شیمی ۱ سال اول متوسطه بخش دوم : در پی هوایی پاکیزه

بخش دوم : در پی هوایی پاکیزه
در پی هوایی پاکیزه:
|
CO2 |
O2 |
N2 |
بخار آب |
گازهای دیگر |
|
|
هوای دم |
%۷۸ |
%۲۱ |
%۰/۰۳ |
%۰ |
%۰/۹۷ |
|
هوای بازدم |
%۷۵/۵ |
%۱۴/۵ |
%۴/۵ |
%۴/۵۶ |
%۰/ |
هواکره را بهتر بشناسیم

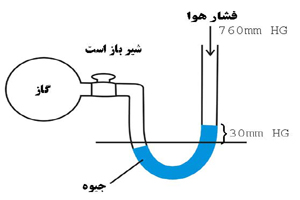
مانومتر

هر گاز محبوس در یک ظرف بر دیواره های آن ظرف فشار وارد می کند . این فشار به کمک مانومتر اندازه گیری می شود . این وسیله از یک لوله V شکل درست شده که درون آن جیوه ریخته شده و دو سر آن بازاست . در حالت عادی ارتفاع جیوه در لوله ها یکسان است اما وقتی یک سر آن را به ظرفی که درون آن گاز است متصل می کنیم بسته به فشار گاز درون ظرف ، ارتفاع جیوه تغییر می کند . از این تغییر ارتفاع فشار گاز به طرف نقطه مورد نظر مشخص می شود .
قانون بویل

در دمای ثابت بین فشارو حجم یک نمونه ی گاز رابطه وارونه وجود دارد ، به طوریکه حاصل ضرب فشار د رحجم مقدار ثابتی است .
قانون شارل

دما نیز مانند فشار بر حجم گازها موثر است . در فشار ثابت حجم یک نمونه گاز با دمای آن نبت مستقیم دارد بهطوریکه نسبت حجم به دما مقدار ثابتی است .
دمای مطلق
لردکلوین دمای c ْ -۲۷۳ را صفر مطلق نامید زیرا پائین تر رفتن از این دما را غیر ممکن می دانست . اگر این دما (c ْ -۲۷۳( را صفر در نر بگیریم و دما را بر مبنای آن بسنجیم ، مقیاس تازه ای برای دما بدست می آید .
۲۷۳+T=TC
نظریه جنبش مولکولی گازها
این نظریه بر چند اصل زیر استوار است :
۱- همه گازها از ذره ها یبسیار کوچکی (اتم یا مولکول ) تشکیل شده اند . ذره هایی که می توان حجم آن ها را در مقایسه ، حجم کل گاز نادیده گرفت .
۲- اتم ها یا ملوکول های گاز پیوسته در حرکتند ، آن ها اغلب با یکدیگر و با دیواره ظرفشان برخورد می کنند . فشار یک گاز قوی نتیجه ی برخورد ذره های سازنده آن ، با دیوار ظرف است .
۳- ذره های یک گاز به هنگام برخورد با یکدیگر می توانند بخشی از انرژی جنبشی خود را از دست بدهد یا به آن بیافزاید اما مقدار کل انرژی جنبشی آنها تغییر نمی کند .
۴- در یک دمای معین میانگین انرژی جنبشی ذرات سازنده گاز ثابت است .
به گازهایی که رفتار آنها با توچه به نظریه جنبش مولکولی گازها قابل پیش بینی است گازهای ایده آل می گویند .
هواکره معدنی سرشار از مواد شیمیایی
اگر هوا را زیر فشار زیاد تا -۲۰۰ C سرد کنیم ، مخلوط بسیار سردی از چند مایع بدست می آید که هوای مایه نامیده می شود . باتقطیر جزء به جزء این مایع می توان اجزای سازنده آن را جدا کرد که نیتروژن و اکسیژن و آرگون از مهم ترین فرآورده های آن است .
اکسیژن ، فراوان ترین عنصر در کره ی زمین
اکسیژن بسیار فراوان است و در هر سه بخش بیرونی کره زمین (هواکره ، آب کره و سنگ کره ) یافت می شود . واکنش هایی را که در آنها اکسیژن به آسانی با عنصرهای دیگر ترکیب می شود ، واکنش های اکسایش می نامند . در این واکنش ها ترکیبات اکسید بوجود می آید . برخی از واکنش های اکسایش سریع و همراه با شعله است که به آن سوخن یا احتراق می گویند .
نقش هواکره
خورشید بر سطح زمین می تابد و آن را گرم می کند. سطح گرم شده ی زمین نیز هوای روی خود را گرم می کند . از آن جا که چگالی هوای گرم کمتر است به سمت بالا حرکت می کند و هوای سرد که چگالی بیشتری دارد به سمت پائین می آید . این جابجایی هوای سرد و گرم عامل تغییر وضعیت آب و هوا در جهان است .
اثر گلخانه ای
نور خورشید مجموعه موج هایی با طول موج ها و انرژی های مختلف است . زمین مقداری از پرتوهای پر انرژی خورشید را جذب می کند و گرم می شود و این گرمارا به مولکول های هوا می دهد و سبب گرم شدن هوا می شود . این پدیده یعنی به دام انداختن و برگرداندن انرژی تابشی به وسیله ی مولکول ها یکربن و دی اکسید و گازهای دیگر موجود در هوا کره را اثر گلخانه ا ی می نامند . در ضمن گازهایی که به این رو شباعث گرم شدن زمین می شوند گازهای گلخانه ای نامیده می شوند مثل ، Co2H2o، CH4 .
در پناه اوزون

اوزون مولکولی سه اتمی با فرمول O3 است . بیش از ۹۰% همه ی اوزون در فاصله ۵ تا ۵۰ کیلومتری سطح زمین جمع شده است . ا.ز.ن تابش فرا بنفش خورشید را که برای انسان مضر است جذب کرده و آن را تبدیل به تابش فرو سرخ می کند که برای انسان ضرری ندارد.
CFC ها یا کلرفلو ئوروکربن ها که از آن ها به عنوان پیشران در افشانه ها و گازهای یخچال استفاده می شود از عوامل تخریب کننده لایه ی اوزون هستند .
آلودگی هوا
امروزه در شهرهای بزرگ آلودگی هوا بر اثر دود خودروها ، نیروگاه های برق یا صنایع و کارخانجات مختلف بوجود آمده است . این آلودگی ضررهای زیادی را به سلامتی انسان ، گونه های جانوران و فرآورده های کشاورزی می زند و ساختمان و خود روها را می پوشاند . بسیاری از فرآیند های طبیعی مثل فوران های آتشفشانی ، طوفان های صحرایی و گازهای مرداب ها و باتلاق ها نیز موجب آلودگی هوا می شوند .همچنین وجود گاز اوزو ن در لایه تروپوسفر یعنی بخشی از هواکره که ما در آن زندگی می کنیم بسیار زیان آور است . اوزون ترپوسفری بر اثر تابش پرتوهای خورشیدی بر مولکولهای No2 بوجود می آید .
باران اسیدی
در شهرهای بزرگ و صنعتی چون گازهای Co2 ، So2 ، H2s و Nox در هوا پراکنده اند . وقتی باران می بارد این گازها را در خود حل می کند وآب باران اسیدی می شود . باران اسیدی به موجودات زنده و ساختمون ها و مجسمه ها و آبزیان آسیب می رساند .


