مقایسه ویژگی های الماس وگرافیت
در الماس هر اتم کربن با چهار پیوند یگانه به چهار اتم کربن دیگر اتصال یافته است. اتم کربن در این حالت ساختاري چهار وجهی با زاویه ي پیوندي 109/5 درجه دارد و هر چهار اتم کربن متصل به آن در چهار گوشه ي یک چهار وجهی قرار گرفته اند.
الماس یک شبکه ي به هم پیوسته از اتم هاي کربن است . بلور الماس را میتوان یک مولکول غول آسا دانست که از اتصال میلیاردها اتم کربن ساخته شده است. موادي از این نوع را که در آن همه ي اتمها به وسیله ي پیوندهاي کووالانسی به یکدیگر متصل شده اند و شبکه اي دو یا سه بعدي ایجاد کرده اند جامدهاي کووالانسی یا جامد مشبک می نامند.
الماس مانند تمام جامدهاي کووالانسی دیگر، نقطه ي ذوب بسیار بالایی دارد زیرا باید بر تمام پیوندهاي کووالانسی بین اتمهاي کربن غلبه کنیم که این امر نیاز به گرماي زیادي دارد.
الماس به دلیل شفاف و زیبا بودن و هم چنین عدم تمایل به واکنش پذیري، براي تهیه زینت آلات در جواهر سازی مورد استفاده قرار میگیرد. از سویی به دلیل سختی زیاد، الماس در تهیه ي نوك مته ها و ابزار برش کاربرد دارد.
الماس سخت ترین ماده شناخته شده طبیعی است. ولی گرافیت نرم است.
جامدهایی که مانند الماس شامل شبکهی سه بعدی به هم پیوستهای از اتمها باشند، جامد کووالانسی یا جامد مشبک نامیده میشوند.
ویژگی های گرافیت
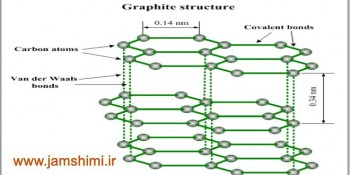
گرافیت که دگرشکل دیگر کربن است برخلاف الماس، ماده ي بسیار نرمی است زیرا ساختاري لایه لایه دارد. در هر لایه، هر اتم کربن با سه پیوند و با آرایش سه ضلعی مسطح با زاویهي پیوندي 120 به سه اتم کربن دیگر متصل شده است. از اتصال شش اتم کربن، شش گوشه هایی ایجاد شده اند که از اتصال آنها به هم صفحهاي مشبک به وجود میآید. از این رو گرافیت را نیز میتوان یک جامد کووالانسی دو بعدي در نظر گرفت. پیوندهاي موجود در هر صفحه بسیار قوي هستند و از این رو هر صفحه را میتوان یک مولکول غول آساي ورقه اي در نظر گرفت.
اما این مولکولهاي صفحه اي غول آسا به وسیله ي نیروي بین مولکولی ضعیف واندروالسی (لاندون) روي هم قرار گرفته اند. از این رو به آسانی روي یکدیگر می لغزند.
گرافیت مانند فلزها رساناي جریان برق است .( تنها نافلز رسانای برق)
گرافیت برخلاف الماس که جامدي سخت و شفاف است، جامدي سیاه و نرم و لغزنده است.
کاربردهاي مهم گرافیت: تولید مغز مداد، ساخت الکترود، روان کننده هاي صنعتی، ماسکهاي شیمیایی، مواد بوگیر و …
سوال۱- نوع نیرو های جاذبه ( پیوند های شیمیایی ) را در الماس و گرافیت مقایسه کنید؟
سوال ۲- دلیل تفاوت در سختی الماس و گرافیت چیست؟
سوال ۳- چرا الماس نارسانا ولی گرافیت رسانای برق می باشد؟
رسانایی برق در اثر وجود یکی از این دو عامل به وجود می آید: آ) وجود یون ب) وجود الکترون آزاد.
الماس رسانای برق نیست چونکه هیچ یک از این دو عامل را ندارد. در بلور الماس هر یک از اتمهای کربن به وسیله چهار اتم دیگر احاطه شده و جامد مشبک ( جامد کووالانسی ) غولآسایی به وجود میآورند. هر یک از دو اتم مجاور در بلور الماس، به وسیله یک پیوند کووالانسی به یکدیگر مربوط شدهاند. این پیوند از همپوشانی دو اوربیتال نیمهپر به وجود میآید. با این ترتیب هر یک از چهار الکترون اتمهای کربن با اتمهای مجاور، به اشتراک درآمده و همهی اوربیتالها را پر میکنند. درنتیجه تمام الکترونهای کربن درگیر پیوند هستند. و هیچ الکترونی در الماس به صورت آزاد نیست که عامل رسانایی شود.
در گرافیت، هر اتم کربن در لایه ي ظرفیت خود داراي چهار اوربیتال تک الکترونی است . در هر لایه، یک اتم کربن با سه پیوند یگانه به سه اتم کربن دیگر متصل است و اوربیتال تک الکترونی چهارم که عمود بر صفحه است با اوربیتال تک الکترونی چهارم کربن مجاور همپوشانی می کند (به صورت رزونانس) عامل اصلی رسانایی الکتریکی گرافیت همین اوربیتال هاي چهارم تک الکترونی هستند ( الکترون های غیر مستقر ). زیرا با وارد شدن یک الکترون به گرافیت، الکترون از سمت دیگر خارج میشود.